CETTE PAGE APPARTIENT AU CLUB MODELISTE DE DIEPPE VOUS POUVEZ VOUS Y RENDRE EN CLIQUANT ICI
L’electro métallurgie
L'anthropologie des techniques et l'histoire des techniques constituent un domaine d'investigation passionnant pour les enseignants chercheurs en sciences humaines, car ils permettent notamment de mettre en évidence les processus de l'innovation technologique, c'est-à-dire la façon dont les ingénieurs, techniciens et artisans procèdent pour apporter des solutions originales à un problème technique donné, le plus souvent avec des moyens simples.Les dictionnaires encyclopédiques de la fin du XIX ème siècle et du début du XX ème siècle constituent en ce sens des sources inépuisables d'informations susceptibles d'application dans tous les domaines, y compris le modélisme. Voyons donc ce que nous apprennent les articles 'galvano-plastie’, électrométallurgie’ et métallisations.
L'électrométallurgie est une branche de l’électrochimie qui a pour but de précipiter un métal sous l'effet d'un courant électrique. Ses applications sont nombreuses : dépôts métalliques, dorure, argenture, galvano-plastie, etc.
En général, quand on soumet une solution métallique quelconque à l'action d’un courant électrique, le métal de cette solution est précipité, mais cette précipitation ne s'effectue pas toujours de la même manière. Dans les cas les plus simples, les produits de décomposition de l'électrolyte sont les éléments dont il se compose. Ainsi, le passage d'un courant électrique dans une solution de cuivre CuCI2 s'accompagne d'un dépôt de cuivre natif sur la cathode et d'un dégagement de chlore sur l'anode. Nous en concluons que les métaux et l'hydrogène se forment en général sur l'électrode négative, tandis que les métalloïdes se dégagent sur l'anode.
Le contrôle de l'intensité du courant et l'état de saturation de la dissolution à décomposer constituent en fait la clé des opérations électrométallurgiques. Mais la température, le degré d'acidité de la solution, sa conductibilité, son homogénéité, la surface des électrodes, la formation de nouveaux sels dans la dissolution compliquent encore le processus. Il convient donc de déterminer expérimentalement l'intensité du courant en fonction de la concentration de la solution, soit en faisant varier le courant en raison inverse à l'épuisement de la solution, soit en maintenant constant le courant, le degré de saturation et l'acidité de la solution qui en détermine la conductibilité. On évite ainsi la formation de bulles d'hydrogène sur la cathode qui altéreraient la pellicule métallique en formation. La surface et le volume de l'anode soluble devront en outre être suffisants pour assurer la régénération de la solution.
Il est enfin essentiel de maintenir dans la mesure du possible la distance entre les différents points de l'anode soluble et de la cathode que constitue l'objet à métalliser pour obtenir un dépôt homogène. Cette distance sera d'autant plus grande que le bain est plus conducteur.
L'électrométallurgie des pièces métalliques ne pose aucun problème puisque ces pièces sont conductrices : mais il n'en est pas de même des pinces constituées de matériaux résistants ou isolants qui doivent recevoir préalablement au traitement électrolytique proprement dit, un revêtement conducteur selon une méthode analogue à celle employée en galvanoplastie. On pourra alors enduire de métal. On pourra alors enduire de métal les substances les plus diverses : plâtre, Porcelaine, graines, fleurs, textiles, etc.
A cette fin, la pièce non conductrice sera préalablement recouverte par une mince feuille de métal, une poudre métallique fine ou enduite d'une solution d'un sel métallique que l'on précipitera par une réaction chimique. La pièce ainsi traitée est désormais conductrice et peut être métallisée par électrolyse. Soulignons toutefois que l'adhérence du métal déposé électrolytiquement sur une surface non métallique est factice et ne présente pas le caractère de soudure d'un métal sur un autre métal. Elle suppose donc que la totalité de la pièce soit enfermée dans le dépôt.



| Graphitage d’une pièce non conductrice | Graphisme à la peinture d’argent sur Dépron avant électrolyse. | Capot moteur Dakota (col de bouteille Coca-Cola) métallisé peinture alu. |
Emploi des poudres métalliques
Argent, bronze, bismuth, etc. peuvent être utilisés en poudre. La plombagine ou mine de plomb (graphite) convient toutefois mieux pour cette opération, compte tenu de son faible coût, de sa très forte adhérence et de sa résistance à la plupart des solutions électrolytiques utilisées en galvanoplastie.
On humecte la pièce à l'eau et on la frotte rapidement avec un pinceau trempé dans la plombagine jusqu'à obtention d'un aspect brillant et uniforme. Les objets en plâtre sont préalablement imperméabilisés en les plongeant dans de la stéarine ou dans de la paraffine fondue jusqu'à ce qu'il ne s'en dégage plus de bulle d'air ni de vapeur d'eau. On saupoudre ensuite de plombagine, on laisse refroidir et on frotte vivement avec un pinceau enduit de plombagine.
Emploi d'une réaction chimique
C'est la seule solution lorsque les objets comportent des surfaces creuses inaccessibles au traitement par poudre. On badigeonne ou on plonge l'objet dans une solution métallique qui l'imbibe plus ou moins et on décompose le sel par un réactif approprié, ce qui en traîne la précipitation du métal.
Le nitrate d'argent est le plus employé pour l'argenture ; il peut soit être dissous dans l'eau et l'alcool (9 parties de nitrate d'argent pour 100 parties d'alcool), sans dans l'ammoniaque si le corps est gras et ne se mouille pas à l'eau. Si la solution ne peut être posée au pinceau, l'objet sera immergé dans une solution de nitrate d'argent dans le sulfure de carbone. Après dessiccation, on réduit le sel d'argent par la lumière, par l'hydrogène ou par une solution concentrée de phosphore dans le sulfure de carbone.
Emploi d'une encre à l'argent
Des encres spéciales à l'argent, vendues dans les boutiques d'accessoires automobiles pour la réparation des lunettes arrières dégivrantes ou dans les boutiques d'électronique pour la réparation des circuits imprimés permettent également de rendre conducteurs les supports les plus variés. On peut encore s'en servir pour écrire ou dessiner des motifs continus sur un support rigide comme le polystyrène extrudé ("Dépron"). le motif est ensuite relié à la cathode du bain et métallisé par électrolyse. Il suffit alors de le décoller de son support pour obtenir une décalcomanie métallique.
Tous les objets recouverts d'un dépôt conducteur peuvent être ensuite métallisés par galvanoplastie dans un bain approprié. Le Nickelage et l’argenture seront toutefois précédés d'un cuivrage pour accélérer le processus et garantir un résultat optimal.
Métallisation par le plomb
Solution de 100 grammes de potasse caustique dans 2 litres d'eau distillée. Ajouter 10 grammes de litharge. Faire usage d'une électrode en plomb et ajouter un peu de litharge. On peut également utiliser comme bain le nitrate de plomb.
Aluminisation
Solution de chlorure double d'aluminium et d'ammonium, ou solution de sulfate d'aluminium concentré acidulé par un peu d'acide sulfurique. On peut également faire passer le courant dans une solution saturée de sulfate d'alumine dans une solution de sel marin, les deux liquides étant séparés par une cloison poreuse. Il se forme d'abord un chlorure double d'aluminium et de sodium qui se décompose ensuite et l'aluminium se porte sur l'objet à recouvrir qui est relié au négatif. L'anode soluble est en aluminium. Un courant de 6 à 7 volts sous 4 ampères convient parfaitement.
Cuivrage
8 à 9 parties d'acide sulfurique dans 1 00 parties d'eau; dissoudre 8 à 9 parties de sulfate de cidre cristallisé pour une solution saturée. Anode soluble de cuivre. La tension requise est de 0,45 V et l'intensité est en moyenne de 10 mA par cm' de surface à recouvrir dans le cas de petites applications où la distance entre anode et cathode n'excède pas 12 CM.
Zingage
1 partie d'acide borique dans 100 parties d'eau ; dissoudre 17 parties de chlorure de potassium et 7 parties de chlorure de zinc pour une solution saturée. Anode soluble de zinc.
Nickelage
60 grammes de sulfate double de nickel et 20 grammes de sel excitateur (?) pour 1 litre d'eau. Anode soluble en nickel. cette solution doit être préalablement électrolysée en y plongeant pendant 24 heures une pièce de cuivre. Tension d'électrolyse : 3 volts. La pièce devra être préalablement cuivrée.
Métallisation à sec
Il s'agit de faire pénétrer dans le corps une émulsion contenant un sel ou une poudre métallique qui adhère à la surface que l'on rend brillante par polissage. Certaines cires d'ébéniste destinées à la dorure ou à l'argenture des cadres peuvent être utilisées sur le bois et sur le plâtre. Selon le même principe, on pourra mélanger de la poudre d'aluminium avec de la cire d'abeilles (à froid) ou avec de la paraffine (à chaud, pour moulage).


Cuve électrolytique avec alimentation variable en tension et en courant. |
Pièce en cours d'électrolyse. Régulation en courant par ampoule à incandescence en série. |
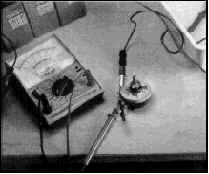

| Régulation par rhéostat bobiné et ampèremètre en série. | Pièce en cours d'électrolyse. |
![]()
Il faut en aucun cas qu’il soit entreposés, manipulés et utilisé qu’avec la plus extrême prudence
( gants, lunettes, éloignement des enfants etc..)
![]()
Extrait de MVM magazine n° 29
